Rhéologie cellulaire : de l’intracellulaire au tissu
Nous intéressons au rôle de la mécano-perception dans la croissance et la morphogenèse des plantes. Nous cherchons en particulier à comprendre comment la pression osmotique et les caractéristiques rhéologiques de la paroi cellulaire sont adaptées aux propriétés physiques de l’environnement.
Membres
- Atef Asnacios, enseignant-chercheur
- Sophie Asnacios, enseignate-chercheuse
- Jean-François Berret, chercheur
- Pauline Durand, enseignante-chercheuse
- Sylvie Hénon, enseignante-chercheuse
- Jean-Baptiste Manneville, chercheur
- Pauline Durand, enseignante-chercheuse
- Alain Richert, assistant ingénieur
- Nathan Martin-Fornier, ingénieur
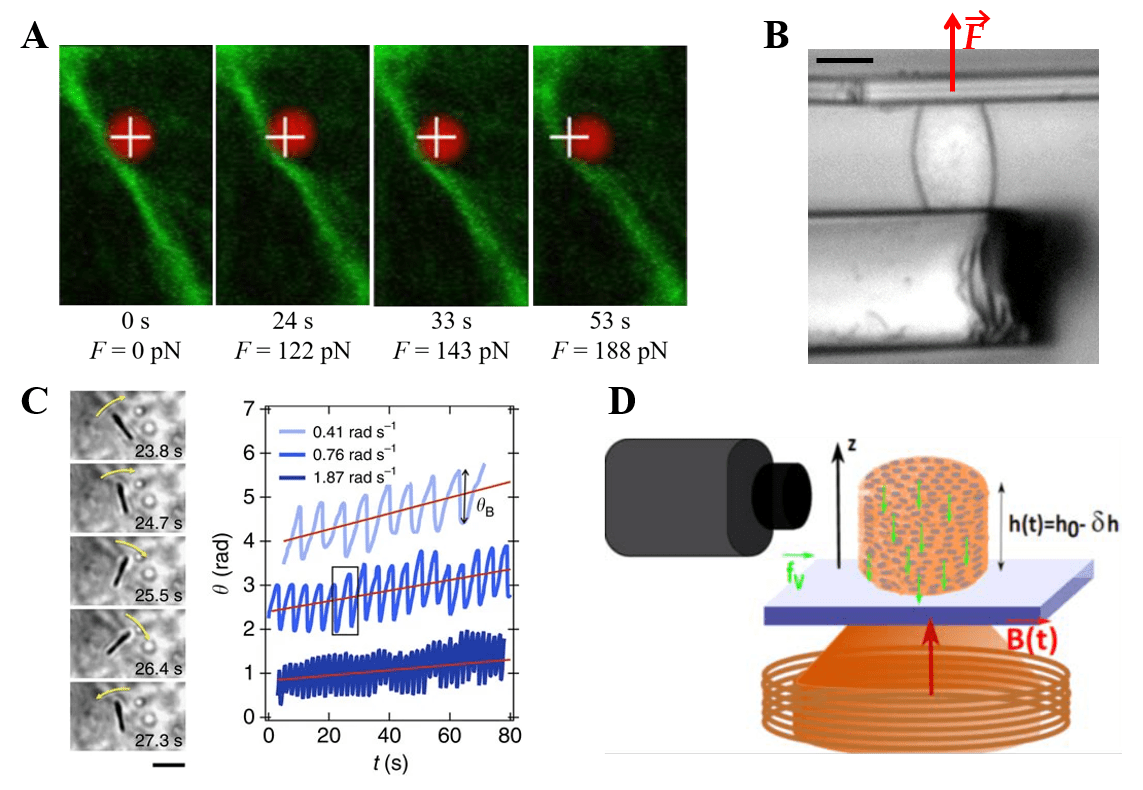
A. Rhéomètre à pinces optiques. Expérience de déflection de filaments intermédiaires de vimentin (vert) dans une cellule vivante. Une bille fluorescente (rouge) de 2 μm de diamètre a été internalisée dans la cellule puis piégée par une pince optique (croix blanche), ce qui permet de lui appliquer une force.
B. Rhéométrie par spectroscopie magnétique rotationnelle. Images d’un nanofil magnétique de 2,8 μm internalisé dans un fibroblaste et soumis à un champ magnétique tournant. Au-dessus d’une fréquence critique, après une rotation dans le sens de rotation du champ (sens horaire), le fil revient rapidement dans un mouvement anti-horaire, ce qui indique que la rotation du fil est entravée. Barre d’échelle : 2 μm
C. Rhéomètre à cellule unique. Une cellule est étirée entre deux micro-lamelles de verre. Barre d’échelle : 20 μm.
D. Rhéomètre magnétique. Un agrégat multicellulaire magnétique est stimulé par un électroaimant, offrant un grand panel de stimulations possibles. Les déformations de la surface sont alors enregistrées et le module élastique de l’agrégat peut être mesuré
